Identifier les risques
Fondamental :
Repérer et identifier les risques d'évènements indésirables dans le processus de prise en charge médicamenteuse en associant une approche a priori et une approche a posteriori
Définition : Gestion des risques a priori
L'établissement doit mettre en place une démarche de gestion des risques médicamenteux a priori comme une étude ou une cartographie des risques encourus par les patients lors de la prise en charge médicamenteuse comprenant notamment :
La définition du processus de prise en charge médicamenteuse à étudier (exemple : circuit des préparations en atmosphère contrôlée, ...)
L'identification des défaillances à chaque étape de la prise en charge médicamenteuse
La priorisation des risques
La mise en place de barrières ou actions pour diminuer la probabilité de survenue ou réduire la sévérité des risques médicamenteux
Définition : Gestion des risques a posteriori
Une organisation est mise en place pour déclarer et traiter les évènements indésirables liés à la prise en charge médicamenteuse notamment :
Les modalités de déclarations internes des évènements
Les critères de sélection des déclarations à analyser en priorité
Les méthodologies pour structurer l'analyse des évènements
Les modalités de transmission des évènements aux autorités dans le cadre des dispositifs de vigilance
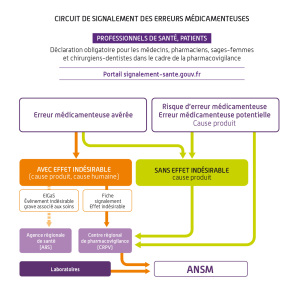
Fondamental : Les évènements indésirables graves associés aux soins (EIGS)
La déclaration des EIGS se fait via le portail de signalement des évènements sanitaires indésirables.
Le formulaire de déclaration comprend 2 parties :
La première partie adressée, sans délai, à l'ARS qui comporte les éléments relatifs à l'EIGS
La seconde partie, adressée au plus tard dans les trois mois, qui comporte une analyse approfondie des causes ainsi qu'un plan d'actions.
Rappel : Critère 3.1-04 « L 'établissement impulse la culture de la déclaration des évènements indésirables dont les presqu'accidents »
Les professionnels de santé sont encouragés à signaler les évènements indésirables liés à la prise en charge médicamenteuse à travers notamment une charte d'incitation à la déclaration
Ces EIAS (dont les évènements porteurs de risque et les EIGS) en lien avec les produits de santé sont détectés par les professionnels et leur collecte est organisée.
Le circuit de transmissions des EIAS respecte le cadre des dispositifs de déclaration en vigueur (pharmacovigilance, ARS, ANSM, HAS, ...)
Attention : Exemple de questions sur les attendus
Les EIGS sont-ils systématiquement déclarés sur le portail de signalement des évènements sanitaires indésirables ? Font-ils l'objet d'un volet 2 au plus tard 3 mois après le volet 1 ?
Une étude des risques encourus par les patients au cours de la prise en charge médicamenteuse est-elle disponible ?
Savez-vous comment déclarer un EIAS lié au circuit du médicament au sein de votre établissement ?
Comment recevez-vous une éventuelle alerte de pharmacovigilance ?
En matière de risques médicamenteux, quels sont vos principaux risques identifiés ?
Méthode : Boîte à outils
Complément : Pour aller plus loin
Article L.1413-14 du CSP (signalement des EIGS)
Articles R.5121-150 à R.5121-201 du CSP (pharmacovigilance)
Déclarer les évènements indésirables graves associés aux soins (HAS, 2022)
Cadre général d'évaluation des démarches d'analyse des évènements indésirables associés aux soins (HAS, 2016)
Comment déclarer si vous êtes professionnels de santé ? (ANSM)